 Plusieurs nouvelles récentes rendent compte des multiples causes du vieillissement qu'il m'a semblé utile de rassembler, avec toutes les incertitudes qui restent, mais plaidant du moins contre une cause unique et exclusive qu'il suffirait de traiter (avec une protéine miracle présentée comme un véritable élixir de jouvence) et plutôt pour des stratégies anti-âge diversifiées et complémentaires.
Plusieurs nouvelles récentes rendent compte des multiples causes du vieillissement qu'il m'a semblé utile de rassembler, avec toutes les incertitudes qui restent, mais plaidant du moins contre une cause unique et exclusive qu'il suffirait de traiter (avec une protéine miracle présentée comme un véritable élixir de jouvence) et plutôt pour des stratégies anti-âge diversifiées et complémentaires.
Il peut arriver que les déterminations génétiques ne dépendent que d'un seul gène mais c'est assez rare. Les phénomènes de complexification des organismes et de sélection naturelle, notamment la sélection de groupe et les pressions écologiques, privilégient plus souvent la conjonction de plusieurs processus dont l'un ou l'autre prend le dessus en fonction de circonstances diverses (stress, surpopulation, infections, nourriture, mode de vie, notamment sommeil et activité physique). Ainsi, on peut identifier une série de facteurs de sénescence : stress oxydatif, mitochondries, télomères, citokynes inflammatoires, baisse hormonale (mélatonine, hormones sexuelles), cellules souches, méthylation et, aux dernières nouvelles, certaines protéines mais il y a aussi toutes les maladies et accidents de la vie, les virus eux-mêmes faisant partie intégrante de la régulation des populations en fonction de leur densité (ce qui nous rend si exposés à une pandémie actuellement). En tout cas, 22 métabolites seraient, paraît-il, un bon indicateur de la longévité.
La plupart du temps on peut dire que ça se dérègle de tous les côtés mais parfois agir sur un seul de ces facteurs peut allonger significativement la vie et il faut souligner qu'il y a quelques espèces où plus ils sont vieux, plus ils se reproduisent et sont performants, la sélection ayant valorisé la durabilité dans des milieux extrêmes comme le désert - confirmation éclatante que le vieillissement n'est pas une fatalité et ne résulte pas d'une simple usure des corps mais se trouve le plus souvent génétiquement programmé (quand le saumon meurt après pondaison, ce n'est en rien un défaut de régulation mais au contraire une optimisation des ressources pour sa descendance qui s'en nourrit).
Une des hypothèses les plus anciennes, défendue déjà par Henri Laborit dans les années 1950, à partir de son expérience de chirurgien dans la marine, est celle du stress oxydatif, des dégâts sur les plongeurs de l'oxygène, et des "radicaux libres" très réactifs qu'il engendre, sorte de rouille s'accumulant dans les cellules, et attaquant l'ADN, jusqu'à leur mort. Cela paraît conforme à l'entropie universelle, sauf que la vie se caractérise justement par le fait de la surmonter (ce qu'on appelle néguentropie). D'une certaine façon, on ne peut qu'être d'accord sur la nocivité des radicaux libres mais la question est plutôt de savoir ce qui empêche à partir d'un certain moment la vie de s'en protéger, ce qu'elle sait très bien faire avant, pendant une durée de vie très variable selon les espèces, et donc génétiquement programmée.
La mode des anti-oxydants vient de là, non sans raisons. Ainsi on a pu constater que, par exemple, les canneberges pourraient prolonger de 30% la vie des mouches par leurs propriétés anti-oxydantes et les bienfaits des anti-oxydants sont prouvés dans un certain nombre de pathologies (comme la dégénérescence maculaire liée à l'âge ou DMLA), sauf qu'ils semblent réduire statistiquement l'espérance de vie de ceux qui en prennent trop (vitamine E notamment), les radicaux libres étant utilisés aussi par le système immunitaire contre les bactéries et nous fragilisant si on s'en prive.
Un chercheur comme Miroslav Radman persiste à vouloir faire du stress oxydatif la principale cause du vieillissement mais en se focalisant sur les protéines réparatrices, c'est-à-dire sur les ratés du mécanisme de correction d'erreur, faisant du vieillissement, une entropie de l'information elle-même, quand les processus réparateurs ne peuvent plus en assurer l'intégrité.
persiste à vouloir faire du stress oxydatif la principale cause du vieillissement mais en se focalisant sur les protéines réparatrices, c'est-à-dire sur les ratés du mécanisme de correction d'erreur, faisant du vieillissement, une entropie de l'information elle-même, quand les processus réparateurs ne peuvent plus en assurer l'intégrité.
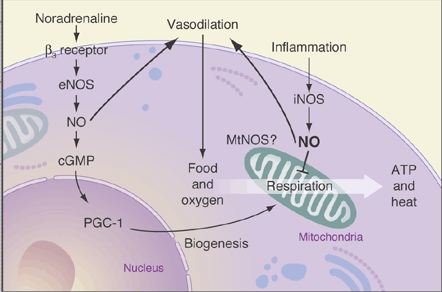
En fait, les radicaux libres affecteraient surtout les mitochondries, puisque ce sont les plus exposées étant responsables de la respiration des cellules en produisant leur énergie à partir de l'oxygène du sang et du glucose. Leur dysfonctionnement se répercute sur l'ensemble des organes et l'état général qui se trouve dépendant de cet "organisme étranger" que tous les eucaryotes exploitent. On peut booster les mitochondries simplement avec de la vitamine C (dont l'excès ne semble pas nocif et qui favorise la production de carnitine) ou bien en augmentant les niveau de NO avec de l'arginine par exemple mais des niveaux trop élevés peuvent cette fois être préjudiciables (inflammation, cancers). Booster les mitochondries avec un facteur de transcription nommé TFAM ferait retrouver mémoire et performance de la jeunesse. Une des façons, connue depuis quelques années, d'allonger la vie consisterait plutôt à observer un régime de "restriction calorique" qui surexprime la protéine SIRT1 (sirtuine) mettant les cellules en mode "survie" plus économe (inhibant le processus AMPK), ce ralentissement métabolique (par compactage de l'ADN) étant à l'origine de l'augmentation de durée de vie observée (mais cela dépendrait du profil génétique de la personne). Le resvératrol, présent dans le vin et qui en constituerait la principale vertu (ce qu'une étude récente conteste et il annulerait les bienfaits de l'exercice !), a la même propriété de stimuler la voie SIRT1 et d'améliorer ainsi les communications entre le noyau et les mitochondries. L'inhibition du gène SLCF-1 mimerait également les bienfaits des restrictions caloriques - du moins chez le ver Caenorhabditis elegans ! C'est la protéine CRTC1 (CREB-regulated transcription coactivator 1) qui permettrait de réduire l'énergie consommée, avec une augmentation de 40% de la durée de vie mais en augmentant aussi le niveau de pyruvate, créant ainsi un stress oxydatif de faible intensité qui se révèle paradoxalement bénéfique. Le rôle ambigu des radicaux libres se confirme donc, délétères en grande quantité mais indispensables en petite quantité par l'activation des processus internes, de même qu'un environnement trop stérile dégrade le système immunitaire (curieusement si les antioxydants font baisser la fertilité des femmes, ils boostent la fertilité masculine).
L'équipe a confirmé le lien entre AMPK et CRTC1 en montrant que la première inactive la seconde en catalysant sa phosphorylation. L'ajout d'un groupement phosphate sur un site précis de CRTC1 désactive en effet cette protéine. Le rôle clé de CRTC1 dans le processus a d'ailleurs été confirmé par l'étude de son interaction avec une autre enzyme, appelée calcineurine, qui joue le rôle d'opposé d'AMPK et retire le groupement phosphate qui désactive CRTC1. En résumé, CRTC1 peut être comparé à un interrupteur du vieillissement, qui peut être soit allumé par la calcineurine, soit éteint par AMPK.
On aurait trouvé un autre moyen d'augmenter le niveau de SIRT1 avec un précurseur nommé NAD+ (dérivé de la niacine ou vitamine PP ou B3) dont la quantité diminue dans les cellules sénescentes. Le résultat aurait été spectaculaire en faisant rajeunir des muscles de souris. On verra d'autres résultats aussi spectaculaires qu'il faut donc relativiser mais qui indiquent des pistes à expérimenter et sans doute complémentaires.
Les scientifiques ont accru les niveaux de NAD+ dans les muscles de souris de 22 mois. Au bout d'une semaine de traitement (deux fois par jour), les marqueurs de l'atrophie musculaire et de l'inflammation avaient baissé et les souris avaient des muscles de leur jeunesse (6 mois).
L'hypothèse des télomères est l'une des plus classiques depuis leur découverte, et compte toujours des partisans puisque ces extrémités de l'ADN limitent le nombre de divisions cellulaires et donc la durée de vie, agissant comme une compte à rebours ou une mèche qui se consumerait lentement mais sûrement. Le mécanisme de reproduction de l'ADN comporte en effet un défaut, celui de ne pas pouvoir le recopier entièrement, raccourcissant à chaque fois ses extrémités, ce qu'on appelle les télomères, dont la longueur détermine au bout de combien de fois des gènes fonctionnels seront amputés et la reproduction s'arrêtera. Il y a cependant une parade puisque la télomérase, une enzyme en général inactivée, peut rallonger les télomères. Miroslav Radman prétend que l'arrêt de production de la télomérase serait due à des processus oxydatifs, ce qui est douteux car son activation est la cause de nombreux cancers avec la reproduction anarchique de cellules devenues "immortelles". La durée de vie serait donc sur ce plan déterminé par l'équilibre entre nombre de divisions cellulaires et risques de cancers mais il ne fait pas de doute que la réactivation de la télomérase amène un rajeunissement des cellules et un gain de vie... quand elle ne déclenche pas un cancer ! Il se pourrait bien malgré tout que la sécrétion de télomérase puisse être variable et liée au stress. La méditation notamment pourrait l'accroître alors que le stress l'inhiberait. A noter aussi que des télomères trop courts sont associés à un fonctionnement dégradé et pourraient aussi bien favoriser les infections que causer des difficultés de concentration par exemple.
Les cliniciens savaient depuis longtemps que l'inflammation était un "tueur silencieux", dérèglement du système immunitaire qui se répercute sur tous les organes provoquant des maladies cardiovasculaires, le diabète, l'Alzheimer, certains cancers, etc. On est cette fois sur une cause moins universelle du vieillissement, liée à l'histoire individuelle et à l'environnement (au stress, la douleur, la solitude, voire une nourriture trop salée) bien que la dégradation du système immunitaire soit incontestablement liée à l'âge (exposant en premier aux infections les plus âgés) et, notamment, à un gène (mTOR) dont l'expression peut être réduite par la rapamycine (mais ce qui expose plus aux infections et problèmes osseux). En tout cas, la prise d'anti-inflammatoires (comme les statines ou l'aspirine) serait bénéfique mais surtout un antidiabétique, la metformine, qui ralentirait le vieillissement et la progression du cancer.
La metformine réduit la production des cytokines inflammatoires qui normalement activent le système immunitaire, mais qui, en cas de surproduction, peuvent mener à une inflammation pathologique, une condition qui endommage les tissus dans le processus du vieillissement et qui favorise la croissance d'une tumeur cancéreuse.
"Avec la metformine, une protéine appelée NF-kB, qui active habituellement les cytokines, ne peut plus les atteindre dans le noyau cellulaire".
Une étude de 2008 avait incriminé 3 gènes dans le déclenchement du vieillissement du Caenorhabditis elegans, sans égard pour l'environnement. Une autre faisait dépendre la longévité de l'insulin growth factor-1 (IGF1) qui semble influencer une cascade d'autres gènes (le gène FOXO3 qui réduit le taux d’insuline dans le sang et la taille allonge également l'espérance de vie). Il y a aussi des "gènes de longévité" comme une variante du gène KLOTHO, appelée KL-VS qui concerne surtout les fonctions cognitives, mais parmi les causes génétiquement programmées, il y a à l'évidence le dérèglement hormonal, étonnamment sous-évalué dans le processus de vieillissement alors que son accélération après la ménopause/andropause a clairement une origine génétique et hormonale, que certains attribuent à la baisse de la mélatonine (sécrétée pendant le sommeil mais dont la baisse déclenche la puberté et la ménopause, étant un puissant anti-oxydant par ailleurs) et ce qu'on essaie de compenser par des traitements hormonaux. Il est indéniable que le système immunitaire est atteint dans cette phase mais cela semble plus une conséquence de la baisse des hormones stéroïdes que de l'accumulation des radicaux libres. On a d'ailleurs trouvé dans l'hypothalamus ce qui pourrait être une "hormone du vieillissement" : la protéine NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells) qui favoriserait l'inflammation et réduirait la sécrétion de GnRH (gonadotropin-releasing hormone), hormone sexuelle nécessaire aussi à la production des neurones. En bloquant cette protéine, les souris vivraient 20% plus longtemps, ce qui n'est pas tant que ça mais démontre du moins que les hormones cérébrales aussi ont un rôle important dans la dégénérescence programmée.
 On arrive aux toutes dernières nouvelles avec l'étude d'une femme ayant atteint 115 ans et morte en 2005 d'un cancer à l'estomac, sans aucune autre pathologie, qui montre qu'elle n'avait plus que 2 cellules souches pour produire ses globules blancs, ce qui constituerait donc une limite à la durée de vie, sauf à produire d'autres cellules souches - ce qu'on réussit à faire depuis peu, la médecine régénératrice commençant à être effective (et l'injection de cellules souches allonge bien la durée de vie de souris).
On arrive aux toutes dernières nouvelles avec l'étude d'une femme ayant atteint 115 ans et morte en 2005 d'un cancer à l'estomac, sans aucune autre pathologie, qui montre qu'elle n'avait plus que 2 cellules souches pour produire ses globules blancs, ce qui constituerait donc une limite à la durée de vie, sauf à produire d'autres cellules souches - ce qu'on réussit à faire depuis peu, la médecine régénératrice commençant à être effective (et l'injection de cellules souches allonge bien la durée de vie de souris).
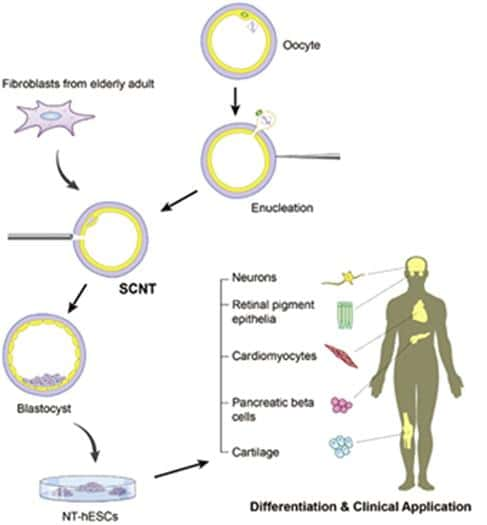
On vient, en effet, d'arriver à produire des cellules souches fonctionnelles à partir de la peau d'un homme de 75 ans.
La technique consiste à retirer le noyau d'un oeuf non fécondé et à le remplacer par le noyau d'une cellule de la peau. Un choc électrique ensuite déclenche la division des cellules jusqu'à ce qu'ils forment un « blastocyste », deuxième étape du développement d'un embryon (après la morula ne comportant que 16 cellules indifférenciées).
Ce qui est destiné d'abord à la régénération d'organes pourrait déboucher facilement sur les premiers clonages humains puisqu'il suffirait d'implanter le blastocyste dans un vagin pour obtenir un clone mais cela constitue incontestablement une des clés de la prolongation de la vie au-delà des limites naturelles en renouvelant le stock de cellules souches. Ainsi, grâce à des cellules souches induites, on a pu constater que le vieillissement du sang serait réversible... chez la souris.
Une équipe suédoise de l’université de Lund a réussi à donner une nouvelle jeunesse à des cellules souches sanguines âgées.
Ils ont reprogrammées des cellules souches hématopoïétiques (CSH) de souris âgées pour obtenir des cellules souches pluripotentes induites (CSPi) qui sont, en théorie, semblables à des cellules souches embryonnaires non différenciées.
L’équipe suédoise a ensuite transplanté ces CSPi dans des souris. Les cellules se sont alors différenciées en CSH puis en cellules sanguines. Pour finir, les auteurs ont comparé la composition sanguine de ces souris à celle de jeunes souris. Leurs résultats montrent que les cellules souches hématopoïétiques reprogrammées retrouvent les mêmes capacités que les CSH de jeunes souris. Le processus de vieillissement du sang semble donc réversible. Selon les auteurs, le facteur qui fait le plus vieillir ces cellules est un agent épigénétique (qui agit sur l'expression des gènes) plutôt que des mutations.
 On passe maintenant au rôle des protéines, moins assuré mais il semblerait bien qu'une protéine de sang juvénile suffirait à rajeunir (des souris). On savait depuis 2010 (si ce n'est depuis Alexandre Bogdanov en 1923) que remplacer par le sang de jeunes celui d'organismes vieillissants était la meilleure façon de retrouver sa jeunesse et reprendre la neurogénèse, entre autres, mais on croyait que c'était l'accumulation de cytokines pro-inflammatoires dans le sang, surtout l'éotaxine (CCL11) qui bloquait la neurogénèse (mais aussi la TGF-ß). Il suffirait même d'un inhibiteur de l'éotaxine pour voir la neurogenèse redémarrer (et la musculation). On avait mis en cause aussi une dérive génétique des globules blancs (notamment les lymphocytes T) qui pourrait être épigénétique plutôt, comme on l'a vu.
On passe maintenant au rôle des protéines, moins assuré mais il semblerait bien qu'une protéine de sang juvénile suffirait à rajeunir (des souris). On savait depuis 2010 (si ce n'est depuis Alexandre Bogdanov en 1923) que remplacer par le sang de jeunes celui d'organismes vieillissants était la meilleure façon de retrouver sa jeunesse et reprendre la neurogénèse, entre autres, mais on croyait que c'était l'accumulation de cytokines pro-inflammatoires dans le sang, surtout l'éotaxine (CCL11) qui bloquait la neurogénèse (mais aussi la TGF-ß). Il suffirait même d'un inhibiteur de l'éotaxine pour voir la neurogenèse redémarrer (et la musculation). On avait mis en cause aussi une dérive génétique des globules blancs (notamment les lymphocytes T) qui pourrait être épigénétique plutôt, comme on l'a vu.
Il semblerait pourtant que la simple injection d'une protéine appelée facteur de croissance de différenciation 11 (GDF11) suffirait à rajeunir le cerveau et les muscles de souris âgées. Le volume des vaisseaux sanguins dans le cerveau aurait ainsi augmenté de 50% et le nombre de cellules souches du cerveau de 29% alors que les fibres musculaires ont doublé de taille. Bien que cette protéine ne procure pas tous les avantages d'un sang juvénile, c'est sans doute la découverte la plus importante mais elle a besoin d'être confirmée chez l'homme et relativisée, pouvant avoir des effets secondaires indésirables (cancer?), même si c'est une piste qui ne doit pas être négligée.
Moins probant car testé sur des souris à vieillissement accéléré génétiquement, une autre protéine PAI-1 (inhibiteur de l'activateur du plasminogène) aurait un rôle dans la dégénérescence des organes. Un médicament expérimental (TM5441) diminuant son activité aurait quadruplé la durée de vie des souris traités, qui ont gardé des organes sains et fonctionnels jusqu'au bout. Tout cela renforce du moins l'hypothèse d'un vieillissement qui n'est pas simple résultat de l'usure du corps.

L'agrégation de protéines mal formées est une des causes des maladies neurodégénératives mais qui renvoie à un dysfonctionnement des processus sensés y remédier, en particulier le drainage du liquide céphalo-rachidien (amélioré par le sommeil et les diurétiques ou simplement en buvant de l'eau). On a constaté aussi une accumulation de défauts de méthylation avec l'âge, responsables notamment de notre déclin cognitif. Il se peut qu'on pourrait y remédier en bonne partie simplement en augmentant la DNA methyltransferase (Dnmt3a2) mais les restrictions caloriques auraient également un effet bénéfique sur ce point. On avait déjà vérifié qu'on pouvait ainsi restaurer la mémoire de souris âgées mais il pourrait aussi y avoir un lien entre gros cerveau, plasticité neuronale et cancer (qui nous distinguent du chimpanzé). En effet, cela expliquerait bien pourquoi les chimpanzés n'ont pas de cancer. Sauf que ce serait sans doute cette moindre méthylation dans le cortex qui serait responsable de notre supériorité cognitive et de la plasticité plus grande de nos neurones. On aurait donc, en même temps, plasticité, démence, vieillissement et cancer. Cette fois, ce serait un avantage pendant la plus grande partie de la vie qui l'écourterait à la fin (à un âge qui était exceptionnellement atteint avant 40 000 ans).
Même s’il existe des variations entre individus liées à plusieurs paramètres, dont l’âge, il s’avère que globalement, les grands singes africains subissent plus de méthylations que nous. Plusieurs centaines de gènes sont concernés, et il s’avère que bon nombre d’entre eux sont étroitement liés à des désordres neurologiques et psychologiques chez l’Homme, ainsi qu’à des cancers.
Il y a enfin d'autres causes de vieillissement sur lesquelles on a peu de prise comme la myélinisation qui est indispensable pour accélérer la transmission nerveuse mais qui constitue un câblage rigide faisant perdre de la plasticité neuronale avec l'âge. Là aussi, on ne peut avoir une chose et son contraire !
Incontestablement, il y a bien une multiplicité de facteurs qui concourent à notre dégénérescence, à différents niveaux qui se traitent de façons différenciées mais contre lesquels on ne semble pas complètement démunis même si on est loin de pouvoir vaincre la mort comme certains nous le promettent un peu rapidement - assez tout de même pour réduire significativement les incommodités de l'âge et atteindre sans doute des longévités déraisonnables...
A l'échelle génétique, les télomères semblent être à l'origine du vieillissement de notre ADN. Au niveau protéique, des accumulations de protéines mal formées sont à l'origine du décès de certaines cellules. A l'échelle cellulaire, le stress oxydatif lié à l'activité des mitochondries est également une source de toxicité. Au niveau de l'organisme l'inflammation accélère la dégradation générale alors que les hormones déterminent les stades de développement et la longévité de l'espèce. A l'échelle macroscopique, l'environnement et la nutrition jouent également des rôles, etc.



Les commentaires sont fermés.